Voordat we de vraag die in dit artikel centraal staat beantwoorden, starten we met een klein stukje geschiedenis. Er is namelijk een mooie mythe die betrekking heeft op lijmen in de oudheid. Deze mythe gaat over Icarus.
Icarus en Daedalus worden door koning Minos gevangengehouden op Kreta, dus Daedalus bedenkt een manier om te ontsnappen. Hij bouwt vleugels die bestaan uit een houten raamwerk, bezet met veren in de vorm van een boog. Die zet hij vast met was. Omdat de was kan smelten, waarschuwt Daedalus Icarus om niet te dicht bij de zon te vliegen. In zijn enthousiasme wordt Icarus roekeloos: hij vliegt te hoog, waardoor de was toch smelt en hij stort neer in de Egeïsche Zee. Kortom: een mooi voorbeeld van hoe externe omstandigheden van invloed kunnen zijn op een lijmverbinding.

De basis van lijmen
Kort gezegd is lijmen het met elkaar verbinden van materialen met behulp van lijm. De officiële definitie van lijm is:
Lijm is een kunststof die losse delen door oppervlaktehechting (adhesie) en sterkte in zichzelf (cohesie) met elkaar kan verbinden.
Bij lijmen verbind je dus twee losse materialen met elkaar door middel van adhesie- en cohesiekrachten. Deze krachten leggen we in het volgende stuk verder uit.
Met lijmen kun je, in tegenstelling tot de meer traditionele verbindingssystemen zoals lassen, popnagels of schroeven, nagenoeg alle materialen met elkaar verbinden. Een groot voordeel van lijmen is dat de te verbinden materialen niet beschadigd hoeven te worden door toevoegen van extreme hitte zoals bij lassen of het boren van gaten zoals bij popnagels en schroeven. Ook vindt de krachtdoorvoering plaats over het totale lijmoppervlak en kunnen thermische uitzettingsverschillen tussen twee verschillende materialen beter worden opgevangen. Voor een goede lijmverbinding is een juiste lijmkeuze en een beheerst lijmproces belangrijk.
Kernbegrippen bij lijmen
Er zijn een aantal kernbegrippen die een grote rol spelen bij lijmen. Deze begrippen lichten we onderstaand een voor een toe aan de hand van een definitie en praktijkvoorbeelden.
Definitie adhesie en cohesie
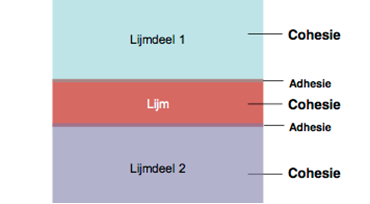
Adhesie is de kracht van een nieuwe verbinding tussen twee verschillende materialen. Cohesie is de interne sterkte van het materiaal of van de lijm.
Afbeelding: illustratie van adhesie in een lijmverbinding
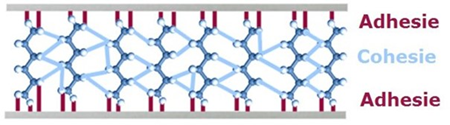
Afbeelding: uitvergroot beeld van de cohesieve krachten in de lijmlaag
Adhesie en cohesie verder toegelicht
Waar kom je adhesie en cohesie tegen in het dagelijkse leven? Het meest tot de verbeelding sprekende voorbeeld is een waterdruppel. In dit voorbeeld is de cohesie (de onderlinge verbinding tussen watermoleculen) verantwoordelijk voor het vormen van een druppel. De adhesie zit in de kleefkracht van de druppel aan de kraan.
Wisselwerking/bindingen bij adhesie en cohesie
Adhesie en cohesie komen tot stand door wisselwerkingen tussen moleculen.
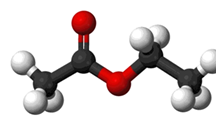
Wisselwerkingen/bindingen tussen moleculen komen op 2 manieren voor:
Fysische wisselwerking/ binding
Bij fysische wisselwerkingen verandert het molecuul niet. Er is wel adhesie (aantrekking tussen verschillende moleculen), maar omdat het molecuul niet wijzigt is deze wisselwerking minder bestand tegen externe invloeden zoals vocht, temperatuur en UV. Een mooi voorbeeld uit de dagelijkse praktijk is de toestand van water. Of water nu kookt, bevroren is of een gas vormt, het molecuul H2O blijft in elke toestand hetzelfde.
Chemische wisselwerking/ binding
Bij chemische wisselwerking verandert het molecuul wel. Het gaat een chemische binding aan met een ander molecuul en vormt zo een nieuw molecuul met een andere samenstelling. Het spreekt voor zich dat dit nieuwe molecuul beter bestand is tegen externe invloeden. Daarnaast kost het veel energie om dit proces terug te draaien. Hieronder twee voorbeelden van een chemische wisselwerking:
- Een boom vormt uit een watermolecuul, zonlicht en een kooldioxidemolecuul een geheel nieuwe molecuul: suiker! Deze suikermolecuul gebruikt de boom om te groeien.
- Een ander praktijkvoorbeeld is de aangekoekte laag die zich vormt op het rooster van een barbecue. De combinatie van vloeistoffen in het vlees en de hoge temperatuur van de barbecue zorgt voor een chemische wisselwerking tussen deze moleculen, die alleen met veel energie (hard schrobben) verbroken kan worden.
Definitie benatting/wetting
Benatting/wetting is de spreiding van een vloeistof over een vast oppervlak, zie onderstaande afbeelding.

Benatting/wetting verder uitgelegd
Hoe makkelijker een vloeistof zich kan verspreiden over een oppervlak, hoe meer verbindingen er tussen de verschillende materialen kunnen ontstaan (adhesie). De algemene stelregel is dat er zonder benatting/wetting geen adhesie kan ontstaan (dus geen verbinding), maar dat een goede benatting/wetting geen garantie geeft voor adhesie.
Definitie oppervlaktespanning
Elk materiaal kent een bepaalde oppervlaktespanning. Om dit oppervlak te vervormen is energie nodig.
De watermoleculen in een druppel trekken elkaar aan, de moleculen in een bulkvloeistof zijn aan alle kanten onderhevig aan even sterke aantrekkingskrachten. Aan het oppervlak worden ze echter alleen aangetrokken door de bulkvloeistof, dus in dit gebied staan ze onder “spanning”.
Oppervlaktespanning verder uitgelegd
Een mooie praktijktoepassing van materiaal waarbij een lage oppervlaktespanning een positief effect heeft, is een pan met een anti-aanbaklaag. Door de extreem lage oppervlaktespanning blijft er niets kleven aan de pan, wat het reinigen van de pan makkelijker maakt. Hoe hoger de oppervlaktespanning van een materiaal, hoe makkelijker de toegepaste lijm een verbinding kan aangaan met dit materiaal.
Een redelijk makkelijk toe te passen test is de waterdruppeltest. Laat hierbij een waterdruppel vallen op het materiaal voor de verlijming. Kijk vervolgens hoe de druppel zich op het oppervlak verdeelt.
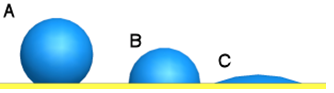
Ziet de druppel eruit als A in bovenstaande afbeelding, dan heb je te maken met een laag energetisch oppervlak (LSE= Low Surface Energy) zoals teflon, polyethyleen, polypropyleen, gepoedercoat metaal et cetera. Ziet de druppel eruit zoals C, dan is de oppervlaktespanning hoog en kan verlijming dus ook beter tot stand komen.
De ondergrens van oppervlaktespanning om een goede verlijming tot stand te brengen, ligt rond de 35 mNm (eenheid voor het meten van oppervlakte-energie). Voor het bepalen van de oppervlaktespanning zijn testinkten of teststiften in de handel die dit eenvoudiger maken.
Samengevat
Er zijn dus een aantal voorwaarden om tot een goede lijmverbinding te komen:
- Adhesie en cohesie zorgen voor een goede wisselwerking tussen gelijke en ongelijke moleculen.
- Een goede benatting/wetting en een minimale oppervlaktespanning, zodat de lijm zich goed kan spreiden en een goede wisselwerking kan aangaan.
- Voldoende chemische en fysische bindingen, waarbij geldt dat hoe meer bindingen er zijn (zeker chemische), hoe sterker de verbinding.